Optimisation des doses de produits de contraste en tomodensitométrie vasculaire et en Oncologie
Quelle quantité de Produit de contraste Iodé injecter (PDC) au scanner (TDM) ?
Cet outil permet de calculer rapidement le volume et le débit de produit de contraste à injecter
Il prends en compte les recommandations du groupe de travail CIRTACI de la SFR
Optimisation des doses de produits de contraste en tomodensitométrie Oncologie
Optimisation des doses de produits de contraste en tomodensitométrie vasculaire
Optimisation des doses de produits de contraste en tomodensitométrie Oncologie
Cet outil permet de calculer rapidement le volume et le débit de produit de contraste à injecter au scanner
Il prends en compte les recommandations du groupe de travail CIRTACI de la SFR
Optimisation des doses de produits de contraste en tomodensitométrie Oncologie
Optimisation des doses de produits de contraste en tomodensitometrie Oncologie
I. Généralités
La justification et l’optimisation sont, comme pour les radiations ionisantes, à la base de l’utilisation des produits de contraste iodés. Ils ne doivent être injectés que s’ils peuvent apporter des informations utiles au diagnostic, avec la quantité d’iode nécessaire et suffisante. L’évolution technologique des scanners permet une acquisition rapide, une zone d’exploration large, une modulation des kV et des mAS, et une optimisation de la qualité d’image et des doses de RX grâce aux nouveaux algorithmes (reconstruction itérative et bientôt intelligence artificielle).
L’injection d’une dose fixe de produit de contraste (PdC) pour tous les examens n’a plus lieu d’être.
L’injection de produit de contraste iodée doit toujours être calculée en fonction du poids du patient.
Enfin, l’abaissement du kilovoltage permet de diminuer la dose d’exposition aux rayons X et la dose de produit de contraste nécessaire.
Une optimisation des protocoles d’injection adaptée à chaque machine doit être réalisée.
Cette fiche se propose une démarche à suivre méthodique pour optimiser les examens selon les protocoles classiques à 120 kV puis en réduisant les kV à 100 kV et envisage le cas particulier des patients obèses.
II. Définitions et formules
- Charge en Iode = Dose d’Iode par Kg de poids corporel g I/kg.
- Volume à injecter = [charge en Iode (g/kg) x Poids (kg) / Concentration du PdC (g/L)], résultat en litres. Multiplier par 1000 pour l’avoir en millilitres.
- Débit d’administration d’iode : DAI g/sec = Concentration du PdC (g/L) x Débit (L/sec),cette variable est à optimiser en vasculaire (cf. fiche vasculaire).
Classiquement entre 0,4 et 0,6 gI/kg, c’est cette dose qui sera à optimiser pour les protocoles d’opacification des parenchymes.
Temps physiologiques d’opacification pour une injection par voie veineuse :
- départ de l’injection à t = 0 sec
- tronc de l’artère pulmonaire : 10-12 sec
- cœur gauche : 22-25 sec
- aorte abdominale : 30 – 35 sec
- temps portal : 70 sec
- temps néphrographique : 90-100 sec
- temps tardif : 3 à 5 min
III. Prococoles d’opacification des parenchymes (Oncologie)
La charge en iode gouverne le rehaussement désiré des organes contrôlé par des critères de qualité (CQ).
1- La dose standard à 120 kV est 0,5 gI/kg
L’objectif est d’obtenir un rehaussement d’environ 50 UH du foie au temps portal (par rapport au foie non injecté). Si le scanner est injecté d’emblée, on cherchera une densité hépatique supérieure ou égale à 110 UH. Si le foie est stéatosique, on cherchera une densité splénique supérieure ou égale à 120 UH.
On calcule donc la dose en fonction du poids du patient, puis le volume à injecter en fonction de la concentration du produit.
Ex. patient de 70 kg injecté avec un PdC à 350 mgI/mL :
0,5 gI/kg x 70 kg = 35 g d’iode donc 100 ml d’un produit concentré à 350 mgI/mL
On construit facilement un tableau (Tableau 1).
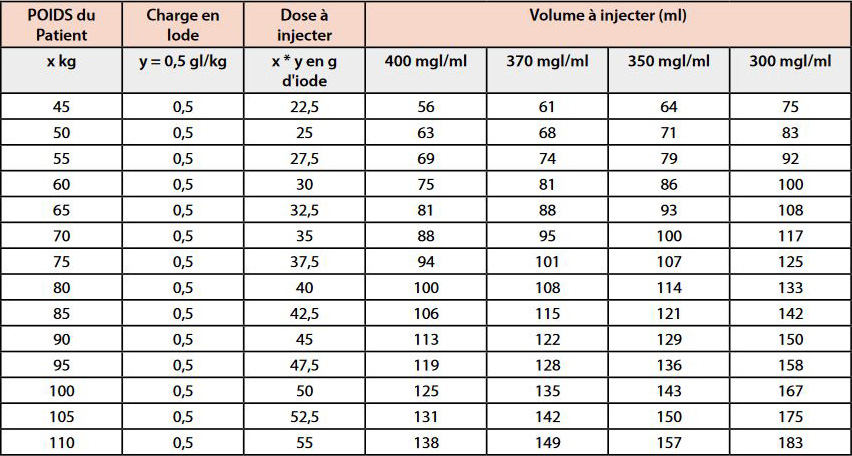
Exemples pour une dose de 0,5 g I /kg. Un calculateur est à télécharger sur le site de la SFR / Cirtaci
Il est possible d’utiliser la surface corporelle (SC) plutôt que le poids mais cela est surtout utile en cas de surcharge pondérale ou d’obésité (cf. chapitre IV) :
A 120 kV : Dose d’Iode g = SC *18,6 g I (Kondo 2013).
2- Débit d’injection
Si un temps vasculaire est nécessaire avant le temps portal, un débit maximal en fonction de l’état veineux est souhaitable.
En oncologie, un temps d’injection de 30 sec permet un débit d’iode satisfaisant pour une imprégnation portale correcte.
Dans tous les cas, l’injection doit être terminée avant la fin de l’acquisition.
On calcule donc le débit en fonction du volume pour avoir un temps d’injection à 30 sec (Tableau 2).
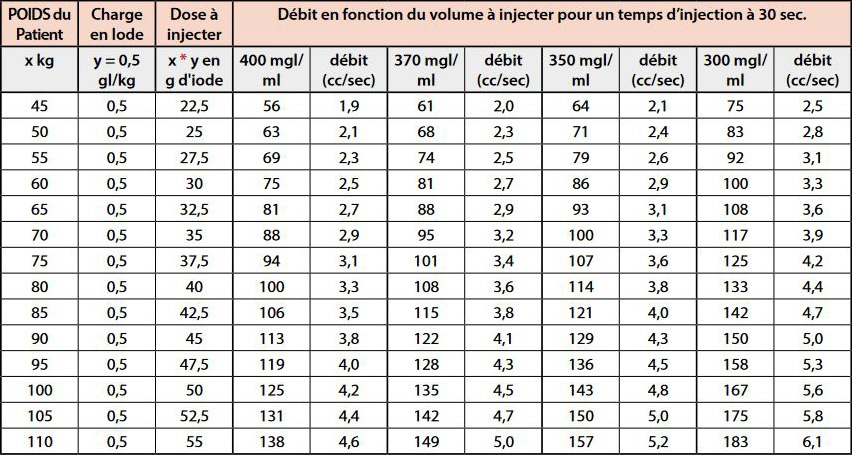
Ces débits théoriques ne sont pas toujours applicables, en particulier en cas de mauvais état veineux.
On sera souvent obligé de limiter le débit à 2 mL/sec et compenser en augmentant la concentration et en rallongeant le temps portal à 80 sec.
3- Autres facteurs d’optimisation
- Rinçage avec du sérum physiologique.
- 30 à 40 ml de sérum sont suffisants pour pousser le PdC résiduel de la tubulure et du réseau veineux proximal.
- Chauffage du produit de contraste à 37°C. Ceci permet de diminuer la viscosité et donc la pression d’injection.
4- Procédure de diminution de dose de produit de contraste
La réduction du kilovoltage permet une réduction de la dose de RX et de la quantité utile de produit de contraste.
-
On vérifiera dans un premier temps la qualité des protocoles de routine (évaluation des pratiques).
- La dose DOIT être calculée par rapport au poids (cf paragraphes I et II) et les Critères de qualité validés :
- Vasculaire ou temps artériel : ≥ 300 UH dans vaisseau
- Parenchyme au temps portal :
- rehaussement de 50 à 60 UH/ foie non injecté
- si injection d’emblée : Foie ≥ 110 UH
- Si stéatose hépatique : Rate ≥ 120UH
- Prendre des mesures correctives si :
- Pas d’adaptation au poids du patien
- Densité UH trop faible : timing ? sérum physiologique ? dose pour parenchyme ? Taux d’iode délivré/sec si vasc : Correction
- Densité UH trop élevée : timing ? dose pour parenchyme ? Taux d’iode délivré/sec si vasc : Correction
- La dose DOIT être calculée par rapport au poids (cf paragraphes I et II) et les Critères de qualité validés :
- Optimisation : baisser les kV puis baisser la dose d’iode.
- Après avoir validé les pratiques habituelles,
- Baisser de 120 à 100 kV le kilovoltage utilisé en abdominopelvien et optimiser les algorithmes (reconstruction itérative, intelligence artificielle) pour compenser l’augmentation du bruit et éviter d’augmenter les mAs (réglages avec le constructeur),
- Reprendre les protocoles validés mais en baissant la charge en iode par palier de 10% (dose d’iode délivrée ou le débit d’iode délivré/sec),
- Contrôle du respect des contrôles de qualité (cf. supra) sur une ou deux journées sur toute une série de patients de toutes morphologies,
- Seconde étape en baissant encore de 10% la dose d’iode délivrée ou le taux d’iode délivré/sec,
- Contrôle du respect des contrôles de qualité (cf. supra) sur une ou deux journées,
- Si la qualité est jugée insuffisante, on revient au palier antérieur.
La baisse des kV permet de rapprocher le spectre d’énergie du faisceau de RX du K edge de l’iode, et donc d’augmenter le pouvoir d’atténuation du produit de contraste.
L’efficacité est identique pour une quantité moindre d’iode, et une plus faible dose d’exposition aux rayons X.
Le but est d’obtenir un rehaussement suffisant des structures opacifiées, contrôlé par la mesure des densités en UH (cf supra) en utilisant le moins de dose de RX et de contraste possible (as low as diagnostically acceptable ou ADARA).
Schématiquement une baisse de 20 kV diminue la dose de RX et d’iode de 20 %.
Ainsi à 100 Kv la dose d’iode pourrait être environ de 0,4 g I/kilo et à 80 kV de 0,32 g I/kilo. Des valeurs identiques sont retrouvées pour l’adénocarcinome du pancréas (Noda 2016).
En cas d’utilisation de la surface corporelle, la dose à 100 kV serait : Iode g = SC * 15 g I et à 80 kV Iode g = SC x 11 g/m 2 (Goshima 2014, 2016).
Méthode générale :
Remarques : Les examens de contrôle abdomino-pelviens tous les 3 mois de patients ayant un suivi carcinologique permettent une comparaison aisée des densités parenchymateuses et vasculaires chez le même patient après avoir modifié les protocoles.
IV. Obésité et dose d’iode en oncologie
L’obtention d’un rehaussement hépatique optimal (50 UH) après injection d’un contraste iodé est particulièrement difficile chez les patients obèses, principalement en raison du bruit plus élevé qui réduit la visibilité des lésions hépatiques. L’amélioration technique des scanners (capteur, reconstruction itérative, intelligence artificielle) a permis une réduction considérable de l’incidence du bruit tout en réduisant l’exposition aux rayons X mais un protocole d’injection de contraste adéquat reste très important.
Un patient obèse présente une proportion élevée de graisse corporelle et un volume sanguin proportionnellement petit par rapport à son poids total, ainsi qu’un petit compartiment extracellulaire bien perfusé.
Le timing du rehaussement et donc de l’injection n’est pas modifié en cas d’obésité car le volume sanguin et le débit cardiaque augmentent proportionnellement.
La graisse corporelle est moins vascularisée que les organes et les muscles viscéraux et le volume sanguin n’est pas linéaire au poids et à la taille.
La dose proportionnelle au poids total surestime la quantité à injecter.
Ainsi, la posologie linéaire proportionnelle au poids peut entraîner une surestimation de la quantité de produit de contraste nécessaire chez les patients en surcharge pondérale ou obèses.
Doses proportionnelles à la surface corporelle ou au poids maigre
D’autres paramètres plus pertinents ont été proposés pour tenir compte de l’obésité et d’éviter le surdosage :
- la surface corporelle (formule),
- le poids maigre (formule ou beaucoup mieux par balance impédancemètre),
- l’indice de masse corporelle n’est pas adapté car ce n’est pas un indice de taille du corps.
Nous retiendrons la surface corporelle qui est la plus utilisée car plus simple :
Formule de surface corporelle (Mosteller)
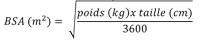
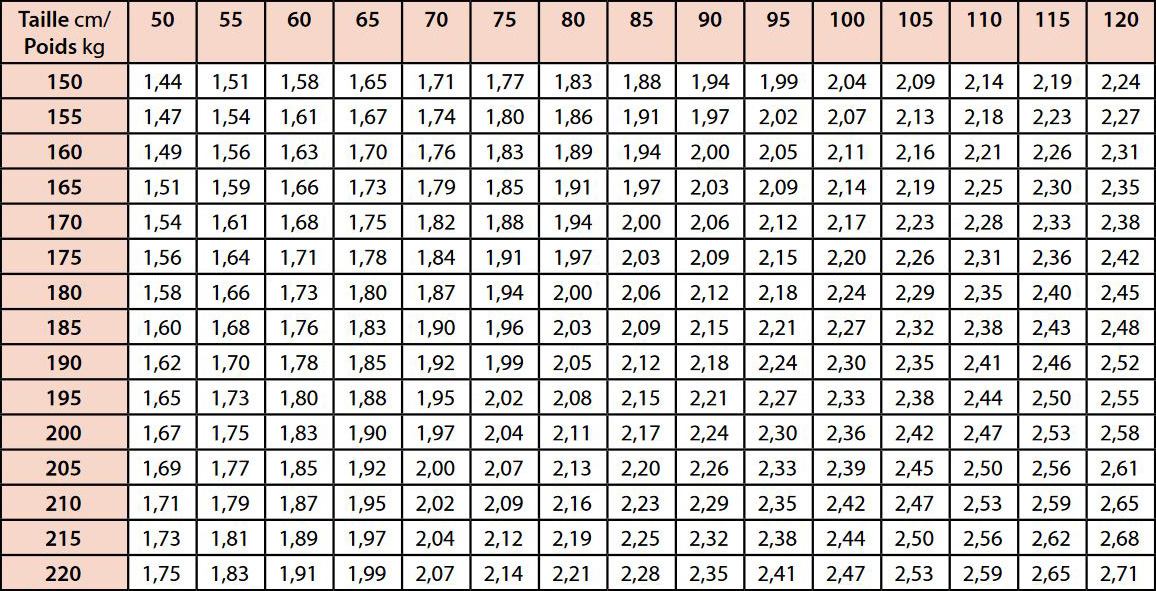
Classiquement à 120 kV, la dose de contraste nécessaire pour les lésions hépatiques est de 0,5 g I/kg (Heiken 1995, Bae 2010) A 100 KV la dose d’iode est de l’ordre de 0,4 g I/kg (cf. supra).
En cas d’utilisation de la surface corporelle, la dose d’iode est à 120 kV de Iode g = SC *18,6 g I (Kondo 2013) et à 100 kV : Iode g = SC * 15 g I.
Les protocoles à 80 kV ne sont pas actuellement adaptés aux patients obèses.
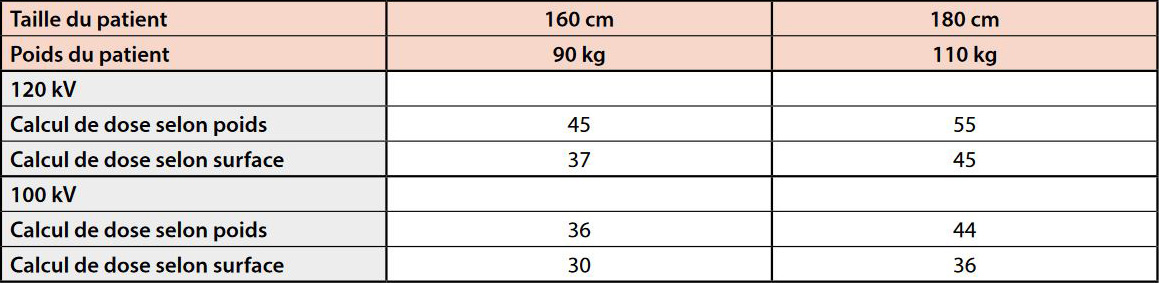
Le tableau 4 montre la quantité d’iode nécessaire selon que l’on calcule en fonction du poids du patient ou de sa surface corporelle. Dans ce cas la diminution de la quantité d’iode est significative (environ 18%).
V. Synthèse
La dose de contraste doit toujours être adaptée au poids du patient
En cas de surcharge pondérale ou d’obésité, il est préférable de calculer la dose en fonction de la surface corporelle pour éviter un surdosage.

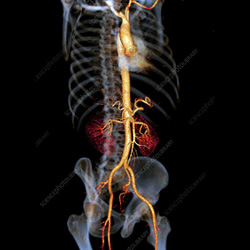
Optimisation des doses de produits de contraste en tomodensitométrie vasculaire
Cet outil permet de calculer rapidement le volume et le débit de produit de contraste à injecter au scanner
Il prends en compte les recommandations du groupe de travail CIRTACI de la SFR
Optimisation des doses de produits de contraste en tomodensitométrie vasculaire
Optimisation des doses de produits de contraste en tomodensitometrie Vasculaire
I. Généralités
La justification et l’optimisation sont, comme pour les radiations ionisantes, à la base de l’utilisation des produits de contraste iodés. Ils ne doivent être injectés que s’ils peuvent apporter des informations utiles au diagnostic, avec la quantité d’iode nécessaire et suffisante. L’évolution technologique des scanners permet une acquisition rapide, une zone d’exploration large, une modulation des kV et des mAS, et une optimisation de la qualité d’image et des doses de RX grâce aux nouveaux algorithmes (reconstruction itérative et bientôt intelligence artificielle).
Pour les protocoles vasculaires, c’est le débit d’administration d’iode qui est le facteur clé à optimiser. L’abaissement du kilovoltage permet de diminuer la dose d’exposition aux rayons X et la dose de produit de contraste nécessaire.
Une optimisation des protocoles d’injection adaptée à chaque machine doit être réalisée.
Cette fiche se propose une démarche à suivre méthodique pour optimiser les examens selon les protocoles classiques à 120 kV, en détaillant le protocole embolie pulmonaire qui est un des plus difficile à mettre en place puis pour optimiser la réduction d’exposition aux rayons X et de dose de contraste utile en réduisant les kV à 100.
II. Définitions et formules
- Débit d’administration d’iode (DAI) :
- Les temps physiologiques d’opacification par voie veineuse (valeurs moyennes indicatives dépendant du débit cardiaque et de l’état physiologique du patient).
- départ de l’injection à t = 0 sec
- tronc de l’artère pulmonaire : 10-12 sec
- ventricule gauche : 17 sec
- aorte crosse : 20 sec
- aorte abdominale : 30 – 35 sec
- membres inférieurs : 40 – 45 sec
- Abord veineux le plus proximal possible,
- Utiliser un cathlon le plus gros possible (vert),
- En cas de mauvais état veineux, on sera souvent obligé de limiter le débit à 2 mL/sec et de compenser en augmentant la concentration.
- Apnée simple, PAS DE VALSALVA
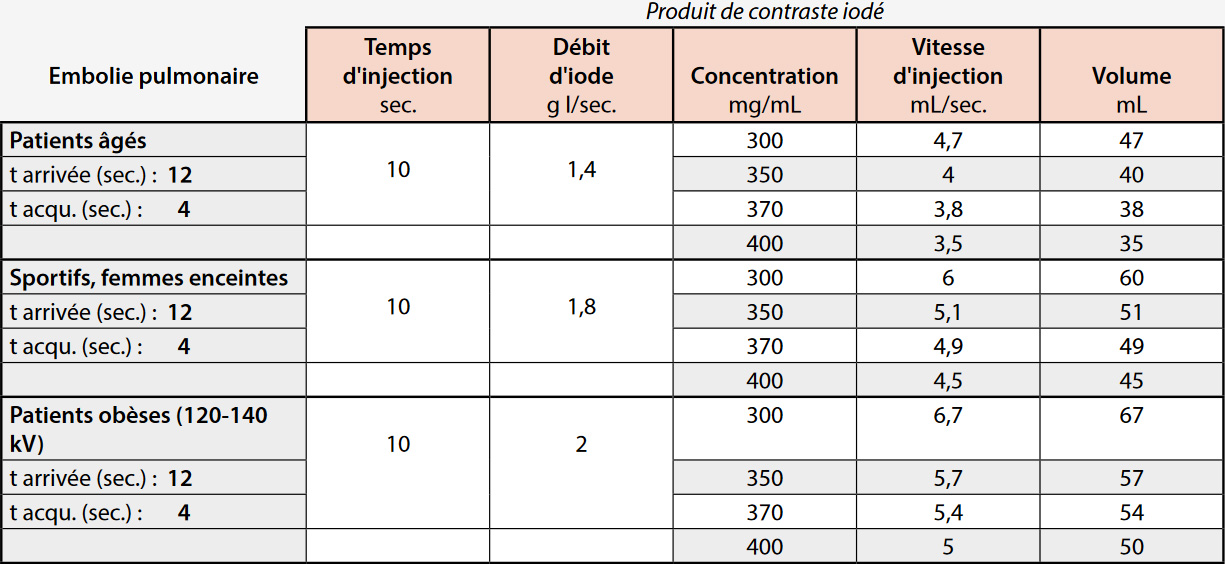
- Patients jeunes, sportifs et la femme enceinte : le débit cardiaque est plus élevé, il faut augmenter le débit d’iode.
- Patient obèse : un kilovoltage élevé (120 kV voire 140 kV) peut être nécessaire, ce qui diminue le pouvoir d’opacification de l’iode nécessitant une augmentation du débit d’administration d’iode (DAI) par augmentation du débit ou de la concentration ou des deux.
- Patient âgé : le débit cardiaque est diminué, il faut diminuer le débit d’iode. Le tableau 4 donne des indications des valeurs du protocole d’injection selon la situation clinique.
- On vérifiera préalablement à toute modification la qualité des protocoles utilisés (évaluation des pratiques).
- La dose doit être calculée par rapport au Débit d’administration d’iode (DAI) (cf paragraphes 1 et 2) avec pour objectif (critères de qualité), une opacification vasculaire ≥ 300 UH dans la lumière du vaisseau
- Si cet objectif n’est pas atteint, il faut modifier le protocole :
- Pas d’adaptation du DAI à l’examen et au patient.
- Densité UH trop faible : regarder le délai d’acquisition, le bolus de sérum physiologique et le débit d’iode et adapter selon le problème détecté.
- Densité UH trop élevée : timing ? regarder le délai d’acquisition et le débit d’iode et adapter selon le problème détecté.
- La deuxième étape consiste ensuite à optimisation son protocole en baissant les kV puis baisser la dose d’iode
- Après avoir validé les pratiques habituelles.
- Baisser de 120 à 100kv le kilovoltage utilisé en vasculaire et optimiser les algorithmes (reconstruction itérative, intelligence artificielle) pour compenser l’augmentation du bruit tout en évitant d’augmenter les mAs (réglages avec le constructeur).
- Reprendre ensuite les protocoles validés mais en baissant le débit d’iode délivré/sec par palier de 10%.
- Contrôle à chaque palier du respect des critères de qualité (cf supra) sur une ou deux journées sur toute une série de patients de toutes morphologies.
- Après validation d’une étape, il est possible de continuer en baissant encore de 10% le taux d’iode délivré/sec.
- Si la qualité est jugée insuffisante, on revient au palier antérieur.
- 120 kV : 1,2 à 1,6 g I/sec
- 100 kV : 1,0 à 1, 3 g I/sec
- 80 kV : 0,8 à 1 g I/sec
DAI g/sec = Concentration du PdC (g/L) x Débit injection (L/sec)
Avec PdC = produit de contraste ; g = gramme ; L = litre ; sec = seconde.
Le critère de qualité est d’obtenir un rehaussement vasculaire ≥ 300 UH.
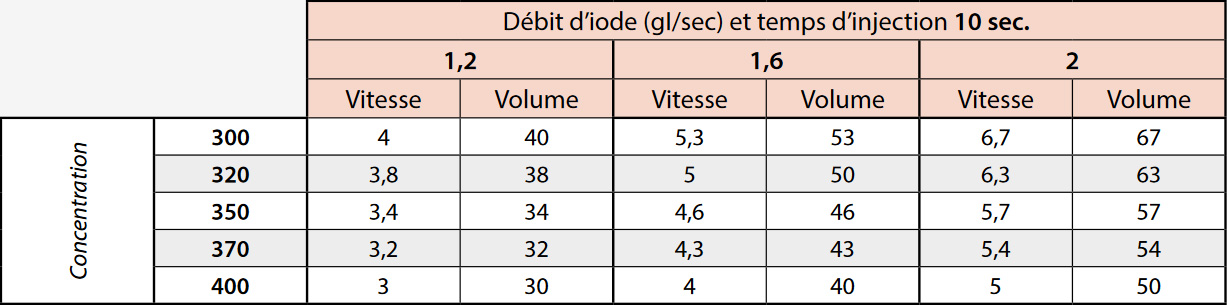
Selon la littérature, le débit d’iode à 120 kV doit se situer entre 1,2 et 1,6 g I/sec en vasculaire général et de 2 g I/ sec pour les coronaroscanners. Le tableau 1 donne ainsi les débits d’injection correspondants en fonction de la concentration du produit :
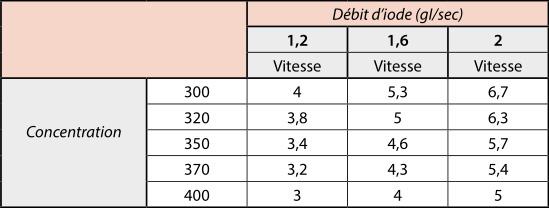
pour mémoire : temps portal : 70 sec, temps tardif : 3 à 5 min
Ces temps conditionnent la durée maximale d’injection en fonction du site anatomique désiré. Il est en effet inutile de continuer à injecter après que le vaisseau d’intérêt a été opacifié, sauf dans les protocoles combinés (temps vasculaire et portal, phléboscanner…).
III. L’injection de sérum physiologique
après ce temps maximum est indispensable pour « pousser » le bolus restant dans la tubulure ou stagnant dans le réseau veineux proximal.
IV. Temps d’injection
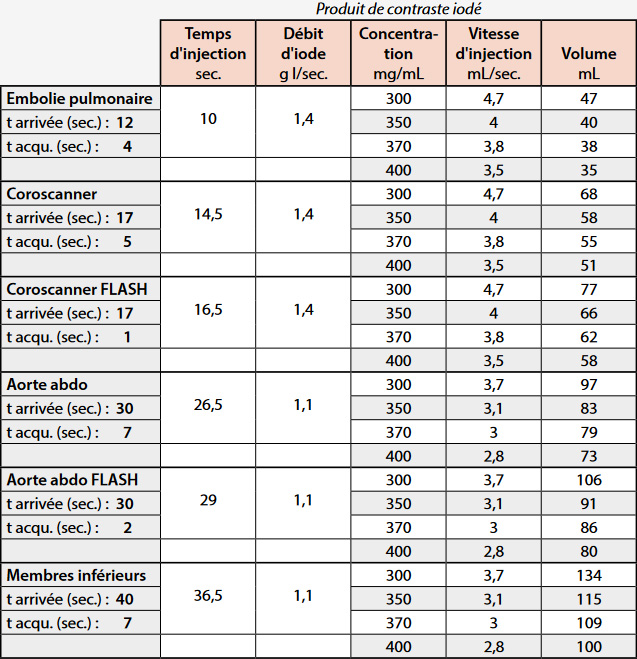
Le temps d’acquisition dépendant fortement du type de scanner, on peut proposer la formule suivante :
Temps d’injection = Temps arrivée du PDC – (temps acquisition / 2)
Pour les scanners ultra rapides, où il faut avoir un volume d’injection légèrement plus important, le départ d’acquisition devra avoir un retard de 2 sec.
En fonction de la formule précédente, le tableau 2 donne les principaux paramètres du protocole d’injection qu’il faudra savoir optimiser par la suite.
V. Protocole Embolie Pulmonaire
Il s’agit d’un des protocoles les plus difficiles à réaliser chez tous les patients, car très sensible au débit cardiaque et à la corpulence. La figure 1 explique la chronologie du passage du produit de contraste au niveau thoracique.
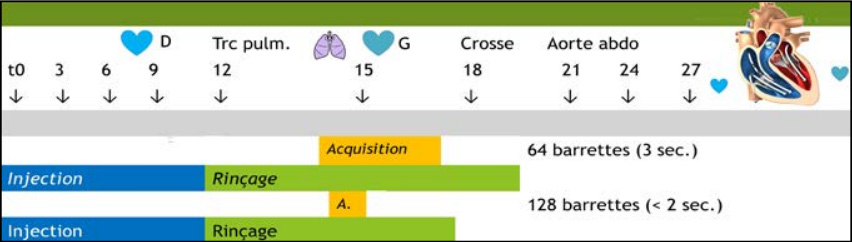
Le produit de contraste met 10 secondes pour arriver jusqu’au tronc de l’artère pulmonaire. L’injection se fera donc AU MAXIMUM sur 10 secondes. Une fois la détection faite, automatique ou visuelle, la machine prend plusieurs secondes avant de démarrer l’acquisition (entre 4 et 7 secondes selon les constructeurs). Cela lui permet de monter en puissance, en vitesse de rotation et de se déplacer sur la première coupe. Dans le même temps, cela permet le rinçage avec du liquide physiologique et donc la récupération du volume résiduel dans la tubulure et dans les veines et rinçage du produit de contraste dans la sous-clavière et la veine cave supérieure limitant les artéfacts de blooming.
L’optimisation du protocole se fera localement pour choisir un débit d’iode (entre 1,2 et 1,6 g I/sec. le plus souvent). Le tableau 3 donne un schéma d’injection selon la concentration en iode du produit utilisé et le débit d’injection.
Règles à respecter :
Situations cliniques particulières :
VI. Procédure de diminution des doses de produit de contraste
Voir également la fiche « Optimisation des doses de produits de contraste en scanner - Oncologie »
La réduction du kilovoltage permet une réduction de la dose de rayonnement et de la quantité de produit de contraste. L’adaptation doit se faire en 2 grandes étapes :
La baisse des kV permet de rapprocher le spectre d’énergie du faisceau de RX du K edge de l’iode, et donc d’augmenter le pouvoir d’atténuation du produit de contraste. L’efficacité en termes de contraste est donc identique pour une quantité moindre d’iode, et une plus faible dose d’exposition aux rayons X. Travailler (ce qui est possible avec la grande majorité du parc installé) avec un kilovoltage bas est un devoir de qualité et d’optimisation du rapport bénéfice /risque. Le but est toujours d’obtenir un rehaussement suffisant des structures opacifiées, contrôlé par la mesure des densités en UH (cf. supra) en utilisant le moins de dose de RX et de contraste possible (as low as diagnostically acceptable ou ADARA).
Classiquement à 120kV, le débit d’iode (DAI) par seconde est de 1,2 à 1,6 gI/ sec. à 100 kV le DAI pourrait être de 0,96 à 1,28 g I/sec et à 80 kV entre 0,76 et 1 g I/sec.
VII. Synthèse
Le débit d’administration d’iode / seconde est l’élément clef en scanner vasculaire.
L’obtention d’une densité du vaisseau étudié de 300 UH nécessite un DAI selon le kilovoltage utilisé de :